温度和饵料对宽体金线蛭仔蛭生长和存活的影响
马春庆,杨代勤 (长江大学动物科学学院,湖北 荆州 434025)
[摘要] 设置 4 组不同的试验温度 (15、20、25、30℃), 随机各放入 100 条宽体金线蛭 (Whitmania pigra) 仔蛭,养殖25d后测定体长、体重和存活率, 探讨了温度对宽体金线蛭仔蛭生长和存活的影响;另外随机设置3个试验组,在相同温度下分别投喂蛋黄、轮虫+ 中华圆田螺、轮虫+ 静水椎实螺, 探讨了饵料对宽体金线蛭仔蛭生长和存活的影响。结果表明: 宽体金线蛭仔蛭在不同温度条件下的生长速度和存活率存在显著差异 (P<0.05)。在水温为25℃ 条件下,仔蛭生长速度最快、存活率最高; 而30℃ 下的仔蛭存活率最低、生长最慢。投喂不同的饵料,仔蛭的生长速度和存活率也有显著的差异 (P <0.05)。投喂轮虫和静水椎实螺组的仔蛭生长速度最快、存活率最高; 投喂蛋黄组的仔蛭存活率最低、生长速度最慢。
[关键词] 宽体金线蛭 (Whitmaniapigra);仔蛭;温度;饵料;生长;存活
宽体金线蛭 (Whitmaniapigra whitmania) 属环节动物门 (Annelida) 蛭纲 (Hirudinea) 无吻蛭目 (Arhynchobdellida) 黄蛭科 (Haemopidae) 金线蛭属 (Whitmania)[1],又名牛蚂蟥、金边大蚂蟥、宽身蚂蟥,是我国传统的药用水生动物。从水蛭唾液提取分离得到的一种多肽水蛭素[2],对凝血酶有极强的抑制作用,是迄今发现的活性最强的特异性凝血酶抑制剂。
国内外对日本医蛭 (Hirudonipponia) 的研究已有较多报道, 但对宽体金线蛭的研究则多侧重于药理和生理方面[3~6],包括药理活性成分的提取和关于其形态结构、呼吸、生长和摄食规律等方面的研究,尤其是在其唾液分泌物中发现的含有肝素及抗血栓素等的化学成分研究[7]。近年来,水蛭的药用范围已延伸到心血管系统、脑血管系统、消化系统和泌尿系统[8]。史红专等[9,10]初步探究了宽体金线蛭的耗氧率与窒息点,确定了宽体金线蛭的最佳产卵温度、体重及卵茧的最适孵化温度。高明等[11]通过对宽体金线蛭食性的研究,得出宽体金线蛭以摄取螺类和河蚌等软体动物的汁液为主, 也摄食植物碎屑、有机质、微生物、蠕虫和水蚯蚓等的结论, 与王安纲等[12]得出的结果一致。但目前对于刚孵化出的仔蛭培育的最适温度和适宜的开口饵料的了解还不多,影响仔蛭生长和存活的因子还有很多也不确定。为 了进一步研究温度、饵料对早期仔蛭生长和存活率的影响, 本研究采用不同温度和饵料对仔蛭进行试验,分别探讨了温度和饵料对宽体金线蛭生长的影响,以为宽体金线蛭的人工繁育提供科学依据。
1 材料与方法
1.1 试验材料
试验水蛭苗种为长江大学水产养殖基地自繁自育、同一批次产出的宽体金线蛭仔蛭, 平均体重为(0.0184±0.0061)g,平均体长为 (1.01±0.17)cm, 体格健壮、活性较强、体表无明显伤痕; 试验所用活体饵料均来自于长江大学动物科学学院水产养殖基地池塘。
试验材料取回后均放置在设有防逃装置的水桶内,置于室内,恒温25℃,暂养3d后开始试验。
1.2 试验方法
试验在长江大学水产养殖基地实验室进行。
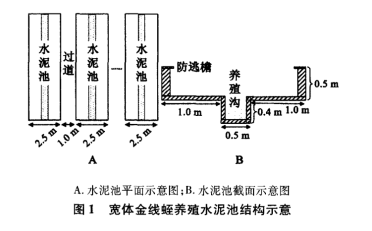
1) 温度对宽体金线蛭仔蛭生长和存活的影响试验 采用 12 个相同规格 (540mm×250mm×400mm) 的蓝色水族箱,保持水位高度为25cm,设置4个试验组,用加热棒进行控温, 温度分别控制为15、20、25℃和30℃,每个试验组各设2个平行,每3 箱为1 个试验组, 均移入100 条仔蛭。试验期间,12个水族箱每次均投喂相同的饵料,投喂量均为每箱30个螺蛳。
2) 饵料对宽体金线蛭仔蛭生长和存活的影响试验 采用 9 个相同规格 (540mm ×250mm ×400mm) 的蓝色水族箱,水温均控制为26℃,每箱移入100 条仔蛭。每3 箱为1 个试验组, 分别投喂蛋黄、轮虫 (Rotifer) +中华圆田螺 (Cipangopaludinacahayensis)、轮虫+ 静水椎实螺 (Lymnaea stagnalis),每箱每天投喂2次, 每次投喂量分别为蛋黄0.5 个、轮虫50mL (50 个/mL) +中华圆田螺 (平均0.1770±0.0660g)30 个、轮虫50mL (50 个/mL) + 静水椎实螺 (平均0.0637±0.0085g)30个。
每天下午5:00对各个水族箱进行换水,用虹吸法排掉底部污物,保持水质的清新。
1.3 指标测定、计算与处理
试验为期25d,结束后,将所有幼蛭用75%酒精进行麻醉,置于装有目测微尺的双筒解剖镜下,测仔蛭体长;随后将仔蛭放于滤纸上, 用电子天平称其重量 (精确到0.0001g), 用镊子轻轻夹取仔蛭后再称量滤纸的重量 (同样精确到0.0001g), 同时统计存活率。按下述公式计算各个试验组的日增重、日增体长。
日增重= (最终平均干重-初始平均干重)/25 日增体长= (最终平均体长-初始平均体长)/25存活率= (存活条数/初始条数) ×100%
试验数据数据经 Excel2007处理后,采用SPSS13.0软件进行单因素方差分析。
2 结果与分析
2.1 不同温度条件下水蛭苗种的生长速率
试验结果如表1所示。方差分析结果显示,不同温度条件下仔蛭的生长速度和存活率存在显著性差异。其中,25℃时,宽体金线蛭仔蛭的生长速度最快, 显著高于其他试验组 (P <0.05), 日增体重达到0.0040g,日增体长达到0.0276cm,存活率也最高,为83.2%;水温在15℃ 时, 仔蛭的生长速度最慢,日增体重仅为0.0017g,日增体长仅为0.0071cm, 显著低于其他试验组仔蛭的生长速度和存活率(P<0.05),但其存活率要高于30℃ 试验组仔蛭的存活率。20℃ 时仔蛭存活率 (80.5%) 与25℃ 下的最高存活率 (83.2%) 没有显著差异,生长速度差异也不显著。
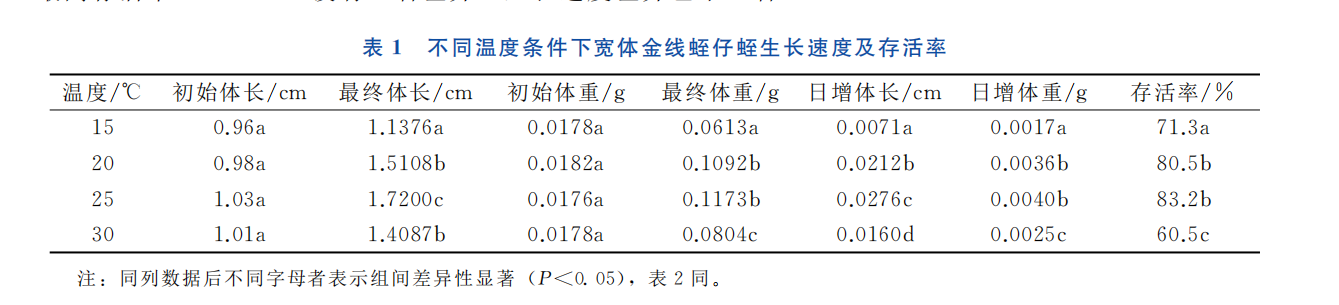 注: 同列数据后不同字母者表示组间差异性显著 (P<0.05), 表2同。
注: 同列数据后不同字母者表示组间差异性显著 (P<0.05), 表2同。
2.2 不同饵料下水蛭苗种的生长速率
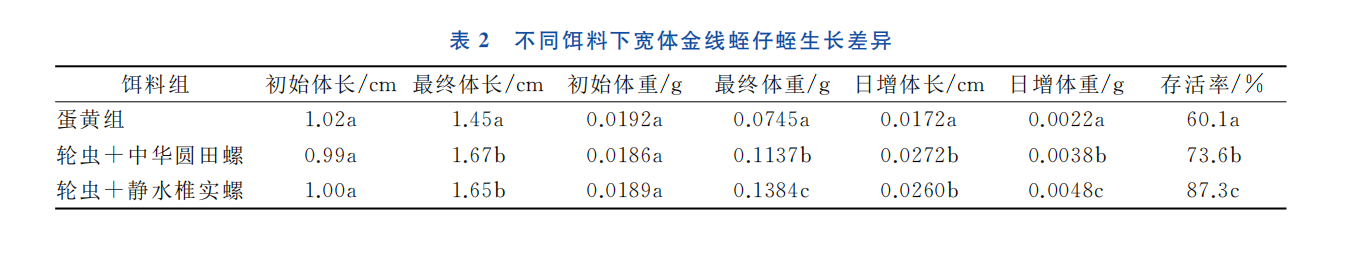
试验结果如表2所示,经方差分析可知,投喂不同的饵料,宽体金线蛭仔蛭的日增体长、日增重及存活率差异显著 (P<0.05),以轮虫和静水椎实螺为饵料的仔蛭存活率最高, 为87.3%, 日增体长达到0.0260cm,日增体重达0.0048g,显著高于其他试验组仔蛭的存活率和生长速度 (P <0.05); 投喂轮虫+中华圆田螺的仔蛭存活率和日增体重都要显著低于轮虫+静水椎实螺的试验组,而两组的日增体长并没有显著差异;蛋黄饵料组仔蛭的日增体重、日增体长仅为0.0022g和0.0172cm,存活率也最低,仅为60.1%,说明饵料采用轮虫和静水椎实螺投喂效果最好,采用蛋黄投喂效果最差。
 3 讨论与结论
3 讨论与结论
3.1 温度对宽体金线蛭仔蛭生长和存活的影响
水生生物的生长发育同时受遗传和外界环境因子的影响,而温度是影响水生生物生长发育最为重要的环境因子,能直接影响参与生物体某些活动所需酶的生物学活性,影响其生命活动的代谢效率以及代谢过程中的能量收支,从而对发育期生物的生长和发育产生影响[13]。宽体金线蛭是变温动物, 当温度范围在适宜其仔蛭生长的范围之间,随着温度的升高,仔蛭的摄食效率和食物转化效率会逐步提高,生长速度也会随之加快。研究表明,适宜宽体金线蛭生长的水温范围为15~30℃[14~16], 此结论与本研究结果基本一致,当水温从15℃逐渐升高到25℃,宽体金线蛭仔蛭的生长速度逐渐变快、存活率也越来越高;但当水温达到30℃时,仔蛭代谢发生紊乱, 常表现为躁动不安, 在水族箱内四处游动, 该温度条件已经成为仔蛭生长的胁迫因子[17], 导致仔蛭死亡。本研究结果显示, 培育宽体金线蛭仔蛭的温度范围最好控制在20~25℃之间,能够有效保证仔蛭长期处于快速生长的状态,同时培育存活率也高。 3.2 饵料对宽体金线蛭仔蛭生长的影响
自然条件下很多鱼类都有相对应的开口饵料生物,鱼类仔鱼期摄食、生长和成活的内在关系,也已成为国际上鱼类早期生活史前沿研究的主要内容之一[18], 而仔鱼开口期的外源性营养对仔鱼的生长和成活起着决定性作用。因此,当仔鱼进入摄食期,及时在最恰当的时机投喂开口饵料,能提高苗种的培育成活率[19]。
宽体金线蛭为动物食性,在水体中多以螺蛳、河蚌、河蚬等软体动物的汁液为食,很少摄食脊椎动物的血液[11,12]。本研究采用蛋黄、轮虫+ 静水椎实螺、轮虫+ 中华圆田螺对宽体金线蛭仔蛭进行开口饵料的选择试验,从试验结果来看,投喂轮虫+静水椎实螺的宽体金线蛭仔蛭成活率最高,生长速度最快,显著高于投喂蛋黄、轮虫+中华圆田螺的试验组 (P <0.05)。轮虫营养丰富, 可供仔蛭摄食, 在水体中也可以起到加快物质循环的速度。静水椎实螺不具角质或者石灰质的厣,而且肌肉和体液中富含 氨基酸等营养物质,方便仔蛭摄食,仔蛭的存活率也可以得到保证;相对而言,具有厣的中华圆田螺不易被宽体金线蛭仔蛭捕获,而且还可能在仔蛭摄食时夹伤仔蛭。所以轮虫+静水椎实螺是宽体金线蛭仔 蛭最好的开口饵料。
综上所述,在人工培育宽体金线蛭仔蛭时, 需要将仔蛭生活的环境温度控制在20~25℃ 之间, 最好不要超过30℃,同时对其投喂轮虫+ 静水椎实螺, 可以达到很好地培育效果; 当饵料不足时, 可辅助投喂部分中华圆田螺,但需要注意先进行消毒处理,充分保障饵料的充足和安全性,达到最大利益。
[参考文献]
[1] 杨潼.中国动物志· 环节动物门· 蛭纲 [M].北京: 科学出版社,1996:1~2,136~139. [2] 李冰宁.水蛭素检测方法研究进展 [J].中国药学杂志,2006,41 (5):321~323. [4]刘丽芳,曾群,金蓉莺,等.中药水蛭各部位提取物对高分子葡聚糖所致大鼠血瘀模型的影响[J].中成药,2003,25(7):589~590. [5]李艳玲,黄荣清,孙晓东.水蛭不同提取物抗凝活性的体外试验研究[J].中药材,2004,27(2):123~125. [6]刘君,杨松松.蚂蝗抗凝血活性成分的分离、纯化及检测[J].中成药,2007,29(4):590~591. [7]吴子忠,熊建新.水蛭养殖技术[J].河北渔业,2002,(3):20~21. [8]刘轶华,穆晓燕,陈保红.水蛭活血成分研究及临床应用[J].中国现代药物应用,2013,7(11):192~193. [9]史红专,刘飞,郭巧生.宽体金线蛭耗氧率与室息点的初步研究[J].中国中药杂志,2005,30(23):15~17. [10]史红专,刘飞,郭巧生.温度和体重对蚂蝗人工繁殖影响的研究[J].中国中药杂志,2006,31(24):2030~2032. [11]高明,侯建华,李双安.水蛭人工养殖技术研究进展[J].黑龙江畜牧兽医(科技版),2013,(3):17~19. [12]王安纲,王祖效.宽体金线蛭的调查及生物学特性的观察[J].水利渔业,2005,25(5):40~41. [13]田相利,董双林.变温对水生生物生长影响的研究进展[J].应用生态学报,2005,16(9):1780~1785.



















 3 讨论与结论
3 讨论与结论